海藻付着細菌による環境モニタリング
熊本大学沿岸域環境科学教育研究センター
教授 瀧尾 進
平成23年10月25日(火)
養殖ノリは有明海・八代海における重要な水産資源のひとつですが、平成12 年には深刻な“色落ち”問題などで生産量は激減し、社会問題となりました。私は,平成13 年の沿岸域環境科学教育研究センター設置を機にノリについて基礎研究を開始し,現在まで「スサビノリ(養殖ノリ)色落ちの分子機構」と「スサビノリのレトロトランスポゾン」を中心に研究を進めてきました(図1)。 |
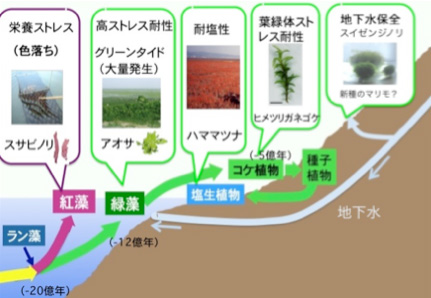 図1 研究テーマと植物材料 |
その後,干潟の環境保全に重要な塩生植物ハママツナや各地で大量発生が問題になっている緑藻アオサなどについても逸見教授と共同研究を行っています。これらの研究についてもこの市民講座や沿岸域センター講演会でご紹介してきました。(熊本大学沿岸域環境科学教育研究センターホームページhttp://engan.kumamoto-u.ac.jp/index.html の「市民公開講座」や「沿岸域センター講演会」のページをご覧ください。)今年から,地下水を中心とした水環境科学についても関わることになり(http://gelk.info/),湧水の藻類についても調べています。今回は,以前から問題となっていたスサビノリの培養トラブルについて,昨年末にやっと1つの進展が得らたので,その成果についてご紹介すると共に,その過程で生まれた新しい研究テーマである「海藻付着細菌による環境モニタリング」についてご紹介させていただきます。
1.スサビノリの植物学上の特徴
生物は原核生物(バクテリア)と真核生物の二つに大別できます(図2左,植物の進化)。
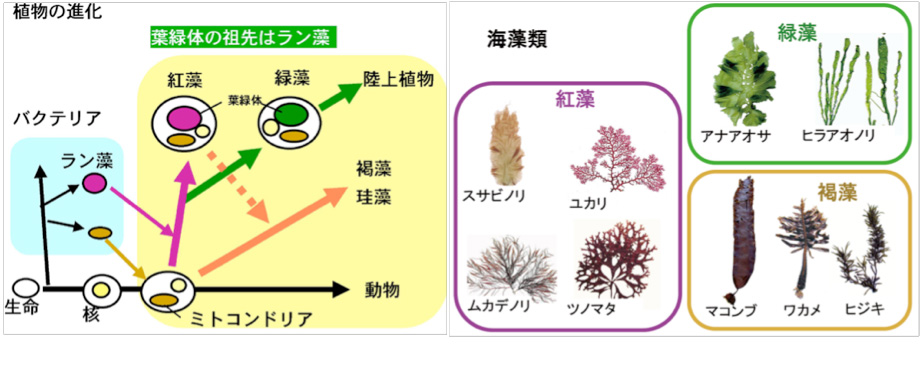
図2 植物の進化(左)と三種の海藻(右)
原核生物では遺伝子の本体であるDNA が裸の状態で細胞内に存在していますが、真核生物ではDNA は核とよばれる膜に包まれた部位に閉じこめられています。真核生物はさらに植物と動物に大別することができ、植物ではDNA は核の他にミトコンドリアや葉緑体にも含まれています。植物の進化において、光合成を行う原核生物であるラン藻が植物の祖先となる細胞に取り込まれて、やがて細胞内で共生し現在の葉緑体になったと考えられています(一次共生)。すなわち,紅藻は植物進化において最初に出現した植物と言えます。紅藻が出現した後,緑藻が生まれ,その仲間は陸上へと進出しました。スサビノリは紅藻で,アオサ類は緑藻に分類されます。なお,コンブやワカメなどの褐藻類や赤潮プランクトンに含まれる珪藻や渦鞭毛藻類は,紅藻が動物細胞にもう一度取り込まれることによって生まれた(二次共生)植物と考えられています。
2.赤潮(r e d tide )とグリーンタイド
「海苔の色落ち」は,赤潮プランクトンの発生などにより海水中の栄養窒素濃度が低下し,海苔の色素が分解することにより起こることが明らかになっています。沿岸域の環境問題として赤潮(redtide)は良く知られていますが,最近ではアオサ類が大量発生するグリーンタイド(green tide)も大きな問題となっています(図3)。グリーンタイドは日本各地でみられ,九州においても博多湾などは良く知られています。熊本県では他県ほど大きな問題とはなっていませんでしたが,最近は顕在化し,新たな環境問題として本格的に取り組む必要がでてきました。 |
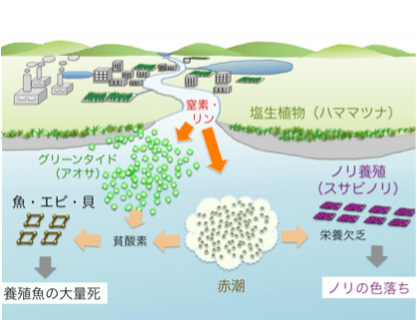 図3 赤潮とグリーンタイド |
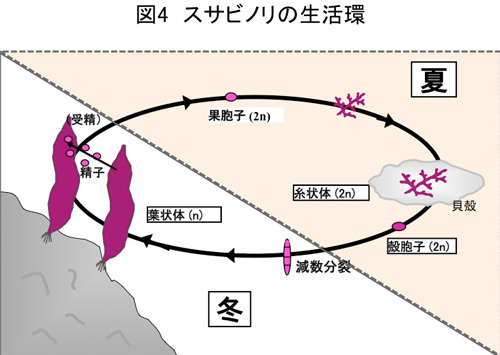
3.スサビノリの一生
食用としているノリの葉状体は半数世代であり,冬期に成長し,春になると授精し倍数世代の糸状体となります。糸状体は貝殻に侵入して夏期を過ごします(図4)。スサビノリではフラスコ内で培養できる純系の培養株が分離されており,私たちはそれらを用いて研究を行っています。糸状体は無菌状態で培養されています。一方,葉状体は完全無菌培養下では成長が悪く,小型のカルス状の細胞塊となり正常な葉状の形態が形成されません。正常な成育には植物体表面に付着する共生バクテリアの共存が必要です。実験室内では主要な生活環は2~3ヶ月で完結します。
 |
 |
この他に若い葉状体上に生じる単胞子が発芽して葉状体となる生活環があり,これは1~2週間で完結します。私達は,単胞子から生じた長さ1~5cm の若い葉状体を実験材料として使用しています。葉状体は15℃,10 時間明期/14 時間暗期,空気の通気により培養を行っていますが,この培養条件では葉状体からの生殖器官の形成は見られません。一方,糸状体の培養温度は葉状体よりも高温の23℃で,連続明所で,通気はおこなわず静置培養されています(図5)。葉状体と異なり,糸状体は無菌状態でも正常に生育できます。私たちも無菌化されたスサビノリ糸状体を使っています。
4.共生細菌による緑藻の分化誘導
緑藻アオサ類は,無菌培養すると正常な形態形成が行えずカルス状の塊を形成し,正常な葉状の藻体に発達できないことが知られていました。このように海中ではバクテリアなどの微生物が種々のビタミンを合成し、海藻の成長を助けていると考えられており、この成長促進物質は半世紀以上前から国内外の研究者がその存在が推定されていましたが、これまでは超微量なために同定されていませんでした。2005年に,日本の海洋バイオテクノロジー研究所の研究グループは緑藻表面に共生するバクテリアの培養液からこれを精製することに成功し,この海藻の新規ビタミン(分化誘導物質)『Thallusin』(サルシン)の構造を明らかにしました(Science 2005,307,1598)。 スサビノリの葉状体もアオサと同様に無菌培養するとカルス状になり正常な葉状体が形成されないことが報告されています。北海道大学の嵯峨直恆教授のグループはスサビノリ葉状体を正常な形態に誘導する能力のある細菌数種をスサビノリ葉状体から2004年に分離しています(Mori et al. Suisanzoushoku 52:239?244) 。その後,スサビノリ葉状体には多数の共生細菌が付着していると考えられいましたが,付着細菌の網羅的分離は行われていませんでした。しかし,2010年にスサビノリ葉状体から23種の細菌と相同性がある配列が分離されました(Namba et al.,2010年, Fisheries Scinence, 76:873?878)。この報告では嵯峨研究室で分離された葉状体形成を促進する細菌は分離されていませんでした。これらのことから,スサビノリ葉状体にはこれら以外の細菌も付着している可能性が考えられました。
5.スサビノリ葉状体の培養トラブル
私たちは,スサビノリの葉状体を人工気象器内で培養しています。以前は人工気象器を廊下において使用していましたが,4昨年の大学の改修工事終了後は,それらは新築の植物培養室に移されました。しかし,移設当初から葉状体を新鮮培地に移すと培養液が白濁化し葉状体の成長が悪く研究を進めることができなくなりました(図6)。 |
 図6 スサビノリ培養液の白濁化 |
不思議なことに,同じ植物培養室内にあるノリの糸状体やノリ以外の植物は正常に生育していました。その後,ノリ葉状体の生長阻害の原因を探っていくうちに,植物培養室内の空気が原因であることが分かりました。そのきっかけは単純なことで,ノリを培養していた人工気象器を廊下に移すと症状は見られなくなることや,実験室の換気扇にVOC 吸着フィルターを装着すると成長が回復することからでした。そこで,幾つかの部屋で培養を試みた結果,私が使用している教員研究室に移すと症状は完全に消失して,以前と同様に正常に生育することが明らかになりました。そこで,仕方なくノリ用の人工気象器2台を私の部屋に移して実験を進めています。
6.スサビノリ葉状体から分離した新規付着細菌
スサビノリ葉状体の培養により生じた白濁培養液から細菌を一種分離し,16S リボソームRNA 遺伝子の塩基配列を調べ,既存の細菌種の配列を比較したところ,ニュージーランドのミドリイガイ養殖場のプロバイオティクとして2010 年に分離されたネプツノモナス属(Neptunomonas)の新種の細菌(Kesarcodi-Watson et al. Aquaculture 309:49-55)と塩基配列が完全に一致しました。また,グラム染色性,胞子の有無,運動性,カタラーゼ反応,オキシダーゼ反応などの生化学テストの結果も上記の細菌とほぼ一致しました。 |
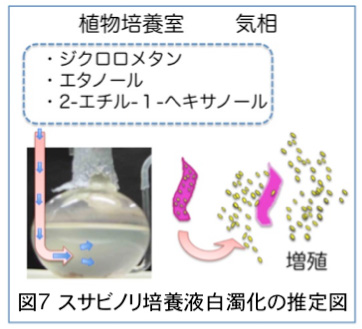 |
ノリ葉状体の培養液を白濁化する原因物質を明らかにするために,室内ガス成分を分析しました。まず,ガスクロマトグラムによる分析では,当然のことではありますが,いずれの部屋も法律で指定されている有害化学物質(ホルムアルデヒド,トルエン,キシレン,パラジクロロベンゼン,エチルベンゼン,スチレン)は検出限界以下でした。しかし,葉状体培養液が白濁化する部屋には,ごく微量ですが他の部屋では検出されない成分があることが分かりました。ガスクロ-質量分析の結果,それらはジクロロメタン,エタノールと2-エチル-1-ヘキサノールでした。Cupriavidusmetallidurans は重金属汚染環境下で生育し,重金属を細胞内に蓄積する性質をもつことから環境浄化の点から注目されていますが,ジクロロメタンを分解することも報告されています。スサビノリ葉状体から分離した細菌BPy−1がこのジクロロメタン分解能をもつか?現在調査中です。
7.海藻付着細菌による環境モニタリング
海藻は二次代謝産物(アレロケミカル)を分泌し,珪藻や細菌の付着を防いでいることは以前から知られていました(図8)。一方,スサビノリ葉状体では形態形成を誘導する細菌も付着していることや,アオサやアマモでは赤潮プランクトンを殺す殺藻細菌が海藻表面に付着していることも報告されています。また,数年前から,海藻表面に付着している細菌群を遺伝子解析したところ,海藻の種類に応じて一定の群集パターンがあることがわかってきました。また,環境が変化するとパターンも変化する例が報告されています。 |
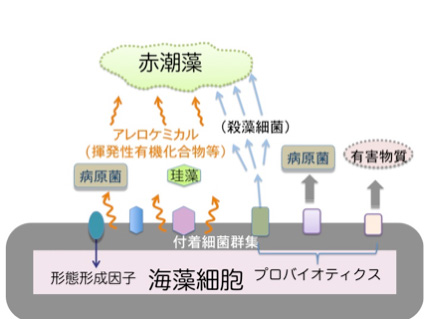 図8 海藻付着細菌の機能 |
有明海・八代海の環境調査では,干潟や底質の土壌環境を微生物群集構造の違いから調べられていますが,海藻に付着する細菌群集から海域環境を考えるとう観点の研究はおこなわれていませんでした。本年度から滝川教授をリーダーとする「八代海再生プロジェクト」がスタートしています。
私たちは、藻場および磯焼け域の海藻に付着する細菌群集を調べ、それらの出現パターンから藻場海藻の生育を制御する環境因子を推定し、培養実験を通してこれらの問題を検証する予定です。実験室内におけるスサビノリ葉状体の付着細菌の研究は自然条件下で見られる海藻と付着細菌との共存関係を知るモデル系となると考えています。
