「海苔ゲノムの解読によって分かったこと」
熊本大学沿岸域環境科学教育研究センター
瀧尾 進
平成25年10月23日(水)
1.はじめに
養殖ノリは有明海・八代海における重要な水産資源のひとつですが、平成12年には深刻な"色落ち"問題などで生産量は激減し、社会問題となりました。私は,平成13年の沿岸域環境科学教育研究センター設置を機にノリについて基礎研究を開始し,現在まで「スサビノリ(養殖ノリ)色落ちの分子機構」と「スサビノリのレトロトランスポゾン」を中心に研究を進めてきました。
今年はスサビノリの核ゲノムの配列情報が公開され,ノリの研究において記念すべき年となりました(http://nrifs.fra.affrc.go.jp/ResearchCenter/5_AG/genomes/nori/index_j.html)。
そこで,今回の講義は,このノリゲノムの解析で明らかになったことを私の研究テーマである「ノリの色落ち」を中心に解説すると共に,ノリのもつ特性について紹介させていただきます。
1.海苔養殖の歴史
ノリ養殖に利用されているスサビノリやアサクサノリは紅藻類のアマノリ属(Pyropia)に属する海産の藻類です。海苔養殖では以前にはアサクサノリが利用されていましたが,スサビノリの方が生長が早く,病気にも強いことから,現在では養殖ノリのほぼすべてがスサビノリ系統となっています。図1はスサビノリの一生の模式図です。食用となる葉状体は半数世代(n,染色体数が2nの半分)で冬に生長します。春先になり精子と卵が葉状体に形成され,受精により受精卵(果胞子)ができ複数世代(2n)となります。果胞子が発芽すると葉状体とは全く異なる形態の糸状体となります。しかも,糸状体は貝殻の表面に付着し,その後,殻の中に侵入して殻の中でカビの菌糸のように増殖します。糸状体の生長は夏期に行われ,秋になると糸状体の一部から殻胞子(2n)が作られ,これが減数分裂した後に発芽し,半数世代の小さな葉状体となり,やがて大きな葉状体へと成長します。
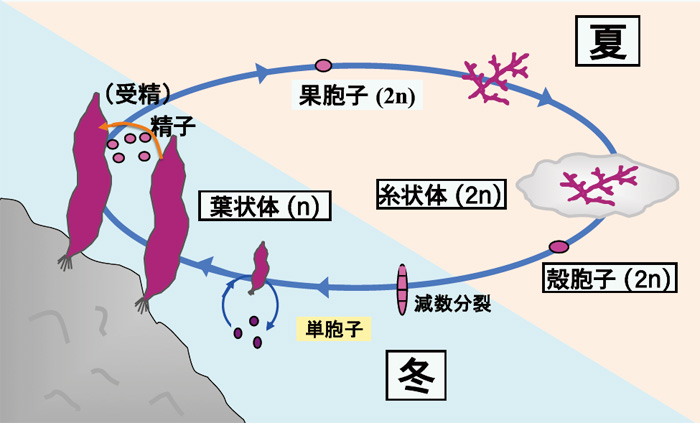
図1 スサビノリの生活環
海苔養殖の歴史は古く,江戸時代には将軍への献上品として栽培されていました。江戸時代に行われた養殖法は,枯れ枝や笹などを海に刺しておき,冬になると知らぬ間に枝に海苔が付着し,それを収穫するという原始的なものでした。しかし,そのやり方は昭和20年頃までほとんど同じでした。植物を育てるためには種子が必要ですが,当時は海苔の種子がどこから来るのかまったく不明だったためです。
イギリスの女性藻類学者のドリュー博士は永年貝殻に寄生する海藻を研究していました。彼女は,この貝殻に寄生する糸状海藻の一種が実は全く別種として分類されていた海苔の葉状体と同じ種であることを発見し,1949年にNatureに発表しましました。その後,熊本県水産研究センターの技師だった太田扶桑男氏は,海苔の糸状体を実験室内で培養し,人工的に殻胞子を作らせる方法を開発しました。殻胞子は海苔の種に相当するものです。このように,ドリュー博士の発見によって毎年確実に海苔の種子を生産することができるようになり,本当の意味での海苔養殖がスタートしたことから,ドリュー博士は「海苔養殖の母」といわれています。全国の海苔養殖の漁師さんにより熊本県宇土市住吉町の海岸に面する小高い丘(住吉神社の敷地内)に記念碑が建立され,毎年4月14日にはドリュー祭が行われています。
2.ノリの植物学上の特徴
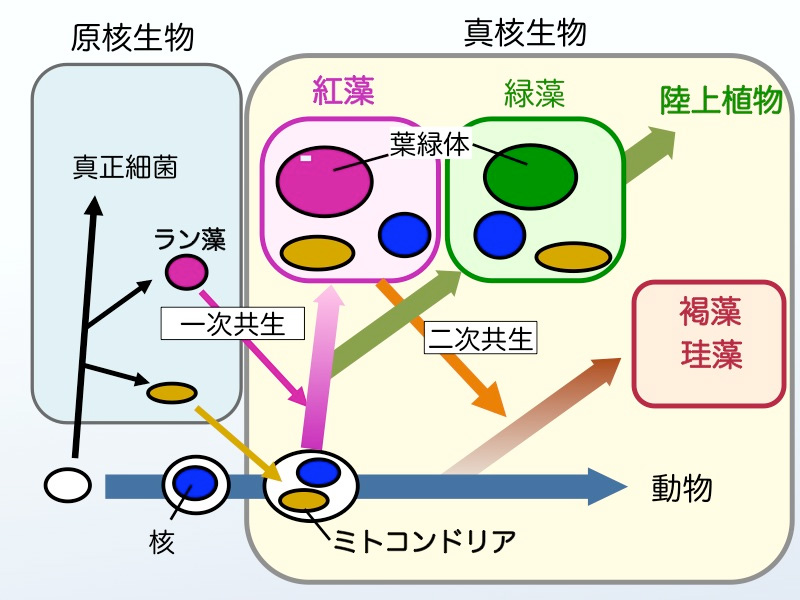
生物は原核生物(バクテリア)と真核生物の二つに大別できます(図2)。原核生物では遺伝子の本体であるDNAが裸の状態で細胞内に存在していますが、真核生物ではDNAは核とよばれる膜に包まれた部位に閉じこめられています。真核生物はさらに植物と動物に大別され、植物ではDNAは核の他にミトコンドリアや葉緑体にも含まれています。植物の進化において、光合成を行う原核生物であるラン藻が植物の祖先となる細胞に取り込まれて、やがて細胞内で共生し現在の葉緑体になったと考えられています(一次共生)。すなわち,紅藻は植物進化において最初に出現した植物と言えます。紅藻が出現した後,緑藻が生まれ,その仲間は陸上へと進出しました。なお,コンブやワカメなどの褐藻類や赤潮プランクトンに含まれる珪藻や渦鞭毛藻類は,紅藻が動物細胞にもう一度取り込まれることによって生まれた(二次共生)植物と考えられています。紅藻は真核生物のなかでもっとも起源の古い植物であることは,「ノリの色落ち」を考える上でも重要な点です。
3.ノリの色と色落ち
図3はスサビノリの葉状体の細胞の顕微鏡写真です(細胞の中心にある大きな赤色の塊が葉緑体)。また,図4はスサビノリ葉状体を各種の溶液で破砕して色素を抽出した結果です。スサビノリには紅色のフィコビリン(フィコエリスリンやフィコシアニンなどの総称)、緑色のクロロフィル、黄色のカロチノイドなどの光合成色素が含まれています。陸上植物の葉は多量のクロロフィルと少量のカロチノイドが含むため,緑色に見えます。スサビノリにもクロロフィルやカロチノイドが含まれていますが,多量な色素はフィコビリンのために藻体は紅色を呈しています。また,図3で分かるように,これらの色素は葉緑体の中に含まれています。
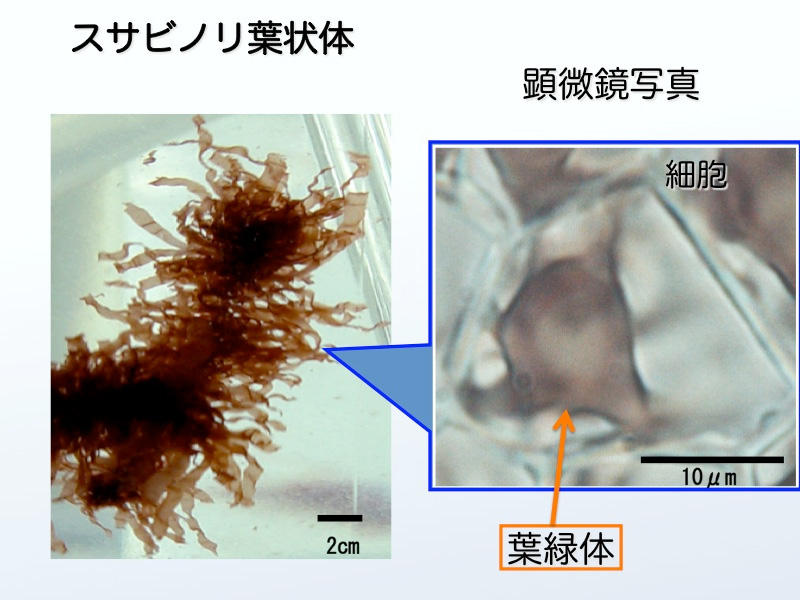
図3 スサビノリの葉緑体
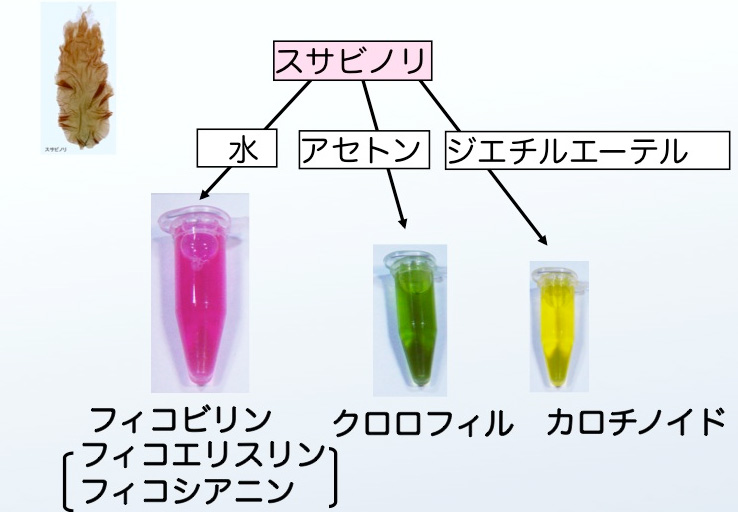
図4 スサビノリの色素
図5は紅藻の葉緑体における光合成反応を模式図です。フィコビリンは光合成に必要な光を集める集光性装置(フィコビリソーム)の構成色素です。緑藻や陸上植物はフィコビリンをもたず、アンテナ色素としておもにクロロフィルを使っているため、葉などの光合成器官は緑色をしています。光合成を行うバクテリアの一種であるラン藻やスサビノリの属する紅藻はアンテナ色素としてフィコビリンを使っている点で他の植物群とは異なっています。「海苔の色落ち」は,赤潮プランクトンの発生などにより海水中の栄養窒素濃度が低下し,海苔の葉緑体中のフィコビリソームが分解することにより起こることが明らかになっています。
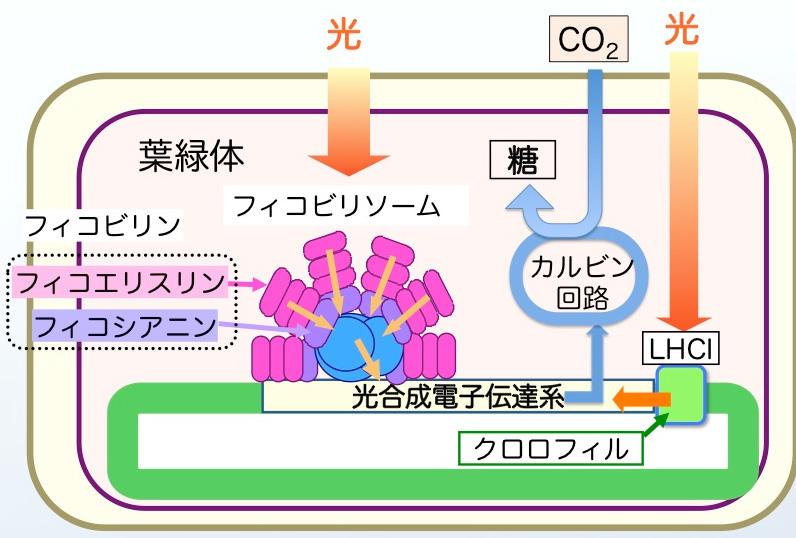
図5 紅藻のフィコビリソーム
4. 養殖ノリの色落ち
赤潮による海苔の色落ちは以下のように説明されています。まず,海水中の栄養塩類濃度が高くなると,海藻よりも成長速度の大きい植物プランクトンが一時的に大量増殖し,その結果,海水中の栄養塩類(特に窒素やリン)濃度が急激に低下します。海水中の栄養分がなくなると赤潮プランクトンも消滅しますが,海苔は海水中の栄養不足のため色落ちが起こります。すなわち,赤潮による海苔の色落ちはノリの栄養ストレスに対する応答と考えられています。
5. ラン藻の「色落ち誘導遺伝子」
前述のように,光合成を行うバクテリアの一種であるラン藻が現存の植物の葉緑体の祖先であると考えられています(図2)。ラン藻は紅藻と同様に,光合成アンテナ装置であるフィコビリソームをもっています。また,ラン藻も栄養欠乏になるとフィコビリソームを分解し,退色します。ラン藻の多くは単細胞でできており,ノリのように多数の細胞からなる植物と比べると体制が単純であり,実験材料として扱い易いことから様々な研究に用いられており,遺伝子情報が完全に解読されている種も多数あります。
栄養欠乏によるフィコビリソーム分解の分子機構についてもラン藻では多くのことが明らかになっています。通常の栄養条件では,ラン藻は活発に増殖し(図6左),フィコビリソームも盛んに合成されます。したがって,フィコエリスリン遺伝子(Cpe)やフィコシアニン遺伝子(Cpc)は活発に発現(mRNAを合成)し,フィコエリスリンやフィコシアニンのタンパク質を合成しています。しかし,窒素欠乏などの栄養欠乏条件下ではこれらの遺伝子の発現が停止し,フィコエリスリンやフィコシアニンのタンパク質の合成が停止します(図6右)。栄養欠乏のときには細胞の増殖も停止するので,フィコビリソームのタンパク質が新たに合成されなくても細胞の色は変化しないはずです。しかし,重要なことは,ラン藻では,栄養欠乏になるとフィコビリソームタンパク質の合成が停止するだけではなく,すでに合成されていたフィコビリソームを積極的に分解する反応が開始することです。このフィコビリソーム分解遺伝子(色落ち誘導遺伝子とも言えます)がラン藻では1991年に発見されています。NblAは通常の栄養状態では発現が強く抑制されていますが,窒素欠乏,リン欠乏,イオウ欠乏などの栄養欠乏条件では発現が誘導され,フィコビリソームの分解が開始されます。NblAは約60個のアミノ酸からなる小さいタンパク質でフィコビリソームタンパク質との結合により分解を誘導すると推定されています。NblA遺伝子の発見の後,正常なラン藻のNblA遺伝子を遺伝子工学的に破壊しても,栄養欠乏でも退色できなくなることが確認されました。また,このようなNblA遺伝子破壊株に外からNblA遺伝子をもつDNAをラン藻細胞内に導入すると,正常な色落ち反応を行うことができるようになることも確認されています。
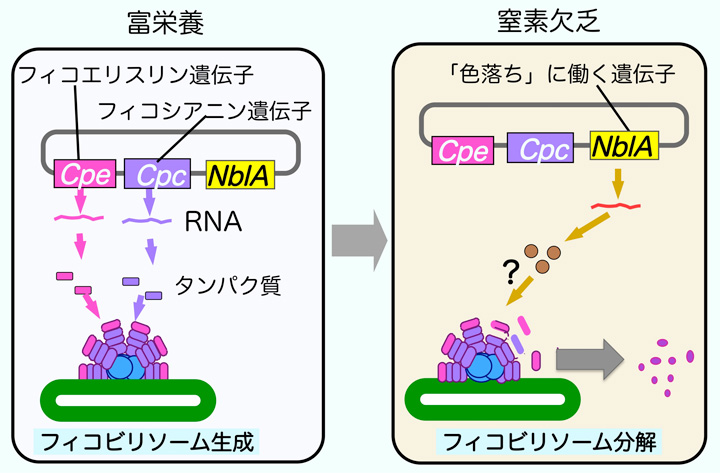
図6 ラン藻の窒素欠乏によるフィコビリソーム分解
6.ラン藻NblAと相同性のあるスサビノリ葉緑体ゲノムのYcf18遺伝子
ラン藻NblAと相同な遺伝子Ycf18が紅藻の葉緑体ゲノムに存在することは15年前から分かっていました(図7)。しかし,Ycf18遺伝子がラン藻NblAと同じ働きをするのかについては調べられていませんでした。私達は,10年前から,スサビノリのYcf18遺伝子の発現様式を調べてきました。
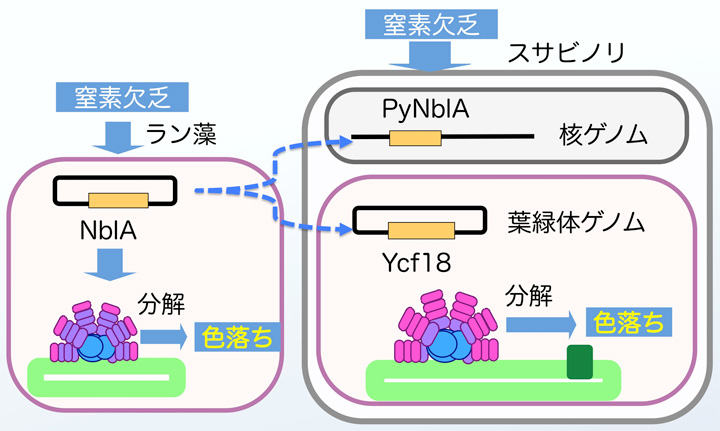
図7 スサビノリの2つのNblA相同遺伝子
スサビノリを通常の培養液から窒素源を完全に取り除いた培養液に移すと,5日後にはフィコエリスリンやフィコシアニンの色素タンパク量は通常の20%以下に減少しました。すなわち,スサビノリは窒素欠乏でフィコビリソームが分解し「色落ち」がおこることが確認できました。フィコエリスリン遺伝子やフィコシアニン遺伝子の発現量(mRNA量)を調べると,窒素欠乏に移して1日目から減少していました。すなわち,窒素欠乏になるとこれらの遺伝子の働きが停止することが確認できました(図8左)。これらの結果は,ラン藻の場合と全く同じです。一方,Ycf18遺伝子のmRNA量は通常状態でもわずかながら検出され,窒素欠乏に移しても変化しませんでした (図8右)。これはラン藻とは著しく異なる結果です。なぜなら,ラン藻NblAは通常状態では発現が強く抑制されていて,窒素欠乏ではじめて誘導されるためです。したがって,スサビノリはラン藻と同様に窒素欠乏によりフィコビリソームを分解する仕組みをもっているが,Ycf18遺伝子はこの反応には働いていないと考えられました。その後,窒素源の種類を従来の硝酸塩からアンモニウム塩に切り替えるとYcf18の発現が増大することが偶然わかりました。アンモニウム塩は硝酸塩と同様にノリにとっては栄養分として利用できるものだったため,この結果は予想外のものでした。なぜYcf18遺伝子がアンモニアによって誘導されるのか?あらたな問題が生まれました。
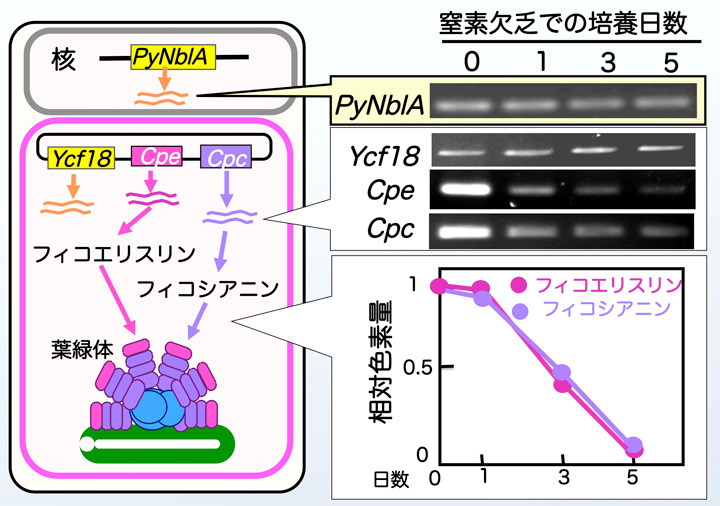
図8 スサビノリPyNblA遺伝子の発現様式
7. 海苔ゲノムによって見つかったもう1つのNblA相同遺伝子,PyNblA
本年,核ゲノムの塩基配列が公開になり,葉緑体ゲノムにあるYcf18遺伝子の他に,もう1つラン藻NblAと相同性のある遺伝子が核ゲノムに存在することが明らかになりました (PyNblA,図8)。アミノ酸配列による分子系統樹から,ラン藻NblAとPyNblAは同じグループに含まれ,紅藻の葉緑体ゲノムにみられたYcf18はラン藻NblAとは異なるグループに分かれました。したがって,核ゲノムにあるPyNblAこそがラン藻NblAと同じ働きをしていると期待されました。そこで窒素欠乏における遺伝子の発現様式を調べたところ,この遺伝子も窒素欠乏に対して応答しませんでした。水産総合研究センターの海苔ゲノム公開のHPで紹介されているように,PyNblAによりノリの色落ちの仕組みが明らかになるのではないかと期待されています。今回ここで紹介したPyNblAの発現様式はラン藻NblAとは異なるため,PyNblAもフィコビリソーム分解には働いていいない可能性も考えられます。しかし,今回はPyNblAの窒素欠乏でのmRNA量の変化しか調べていません。PyNblAが葉緑体に移行するのか?など,PyNblAの働きについて様々な観点から解析が必要と思われます。
