養殖ノリ糸状体の環境ストレス応答
熊本大学沿岸域環境科学教育研究センター
教授 瀧尾 進
平成20年10月29日(水)
養殖ノリは有明海・八代海における重要な水産資源のひとつですが、平成12年には深刻な“色落ち”問題などで生産量は激減し、社会問題となりました。私は、平成13年の沿岸域環境科学教育研究センター設置を機にノリについて基礎研究を開始し、現在まで「スサビノリ(養殖ノリ)色落ちの分子機構」と「スサビノリのレトロトランスポゾン」を中心に研究を進めてきました。従来の研究では、材料は食用として重要であることから葉状体を用いていました。しかし、昨年糸状体を調べたところ葉状体とは異なるストレス応答能をもつことがわかりました。まだ、研究は始まったばかりですが、今回はなぜ糸状体の生理特性に興味をもったか、また、糸状体に特徴的な生理特性やストレス応答能について紹介いたします。
【1.ノリとはどのような植物か?】
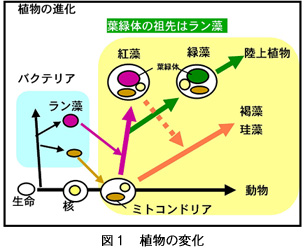 ノリ養殖に利用されているスサビノリやアサクサノリは紅藻類のアマノリ属(Porphyra)に属する海産の藻類です。生物は原核生物と真核生物の二つに大別できます。真核生物はさらに植物と動物に大別することができ、植物では遺伝物資であるDNAは核の他にミトコンドリアや葉緑体にも含まれています。
ノリ養殖に利用されているスサビノリやアサクサノリは紅藻類のアマノリ属(Porphyra)に属する海産の藻類です。生物は原核生物と真核生物の二つに大別できます。真核生物はさらに植物と動物に大別することができ、植物では遺伝物資であるDNAは核の他にミトコンドリアや葉緑体にも含まれています。
植物の進化において、光合成を行う原核生物であるラン藻が植物の祖先となる細胞に取り込まれて、やがて細胞内で共生し現在の葉緑体になったと考えられています(一次共生、図1)。そして、葉緑体の性質などから紅藻は真核生物のなかでもっとも起源の古い植物であると考えられています。
【2.ノリの色と色落ちのしくみ】
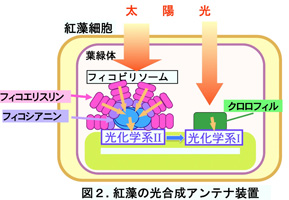 スサビノリにはフィコビリン、クロロフィル、カロチノイドなどの光合成色素が含まれています。フィコビリンにはおもにフィコシアニン、フィコエリスリン、アロフィコシアニンが含まれ、これらは光合成の反応に必要な光を集めるためのアンテナの働きをする装置(フィコビリソーム)の構成色素です(図2)。
スサビノリにはフィコビリン、クロロフィル、カロチノイドなどの光合成色素が含まれています。フィコビリンにはおもにフィコシアニン、フィコエリスリン、アロフィコシアニンが含まれ、これらは光合成の反応に必要な光を集めるためのアンテナの働きをする装置(フィコビリソーム)の構成色素です(図2)。
緑藻や陸上植物はフィコビリンをもたず、アンテナ色素としてクロロフィルを使っているため、葉などの光合成器官は緑色をしています。光合成を行うバクテリアの一種であるラン藻やスサビノリの属する紅藻はアンテナ色素としてフィコビリンを使っている点で他の植物群とは異なっています。ただし、紅藻ではアンテナ装置としてフィコビリソームの他にクロロフィルでできたアンテナ装置(LHCI)をもち、ラン藻にはこの装置がない点は異なっています。
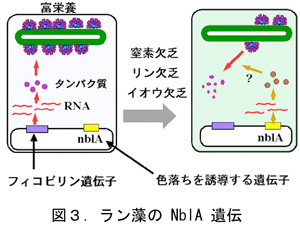 ラン藻や紅藻は窒素やリンなど栄養分が欠乏するとフィコビリソームを分解し、色落ちをおこします。ラン藻では「色落ちを制御する遺伝子」としてNblAが同定されています(図3)。NblAと相同性のある遺伝子が紅藻の葉緑体にありますが、その働きは不明でした。私たちは、養殖ノリの色落ちの仕組みを考えるため、この遺伝子の発現様式について調べてきました。しかし、この遺伝子はラン藻とはまったく異なる発現様式を示しました。紅藻も葉緑体の祖先であるラン藻と同様に栄養欠乏によりフィコビリソームを分解しますが、その調節の仕組みはラン藻とは異なっているようでした。
ラン藻や紅藻は窒素やリンなど栄養分が欠乏するとフィコビリソームを分解し、色落ちをおこします。ラン藻では「色落ちを制御する遺伝子」としてNblAが同定されています(図3)。NblAと相同性のある遺伝子が紅藻の葉緑体にありますが、その働きは不明でした。私たちは、養殖ノリの色落ちの仕組みを考えるため、この遺伝子の発現様式について調べてきました。しかし、この遺伝子はラン藻とはまったく異なる発現様式を示しました。紅藻も葉緑体の祖先であるラン藻と同様に栄養欠乏によりフィコビリソームを分解しますが、その調節の仕組みはラン藻とは異なっているようでした。
【3.ノリの一生】
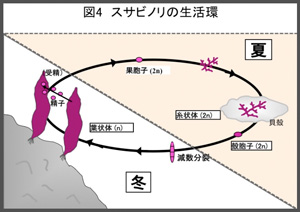 食用としているノリの葉状体は半数世代であり、冬期に成長し、春になると授精し倍数世代の糸状体となります。糸状体は貝殻に侵入して夏期を過ごします(図4)。
食用としているノリの葉状体は半数世代であり、冬期に成長し、春になると授精し倍数世代の糸状体となります。糸状体は貝殻に侵入して夏期を過ごします(図4)。
スサビノリではフラスコ内で培養できる純系の培養株が分離されており、私たちはそれらを用いて研究を行っています。糸状体は無菌状態で培養されています。一方、葉状体は完全無菌培養下では成長が悪く、小型のカルス状の細胞塊となり正常な葉状の形態が形成されません。正常な成育には植物体表面に付着する共生バクテリアの共存が必要です。実験室内では主要な生活環は2〜3ヶ月で完結します。
 この他に、若い葉状体上に生じる単胞子が発芽して葉状体となる生活環があり、これは1〜2週間で完結します。私達は、単胞子から生じた長さ1〜5cmの若い葉状体を実験材料として使用しています。葉状体は15℃、10時間明期/14時間暗期、空気の通気により培養を行っていますが、この培養条件では葉状体からの生殖器官の形成は見られません。一方、糸状体は培養温度は葉状体よりも高温の23℃で、連続明所で、通気はおこなわず静置培養されています(図5)。葉状体と異なり、糸状体は無菌状態でも正常に生育できます。私たちも無菌化されたスサビノリ糸状体を使っています。
この他に、若い葉状体上に生じる単胞子が発芽して葉状体となる生活環があり、これは1〜2週間で完結します。私達は、単胞子から生じた長さ1〜5cmの若い葉状体を実験材料として使用しています。葉状体は15℃、10時間明期/14時間暗期、空気の通気により培養を行っていますが、この培養条件では葉状体からの生殖器官の形成は見られません。一方、糸状体は培養温度は葉状体よりも高温の23℃で、連続明所で、通気はおこなわず静置培養されています(図5)。葉状体と異なり、糸状体は無菌状態でも正常に生育できます。私たちも無菌化されたスサビノリ糸状体を使っています。
遺伝子組み換え技術を使ってラン藻のNblA遺伝子を破壊すると「色落ち能が失われる」ことも証明されています。
【4.糸状体と葉状体のストレス応答能】
ア)窒素欠乏による色落ち
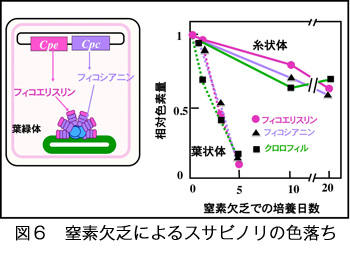
スサビノリの葉状体では海水中の窒素分が欠乏すると素早く色落ち(フィコビリソームの分解)がおこります。一方、糸状体ではその応答は非常に緩やかでした(図6)。
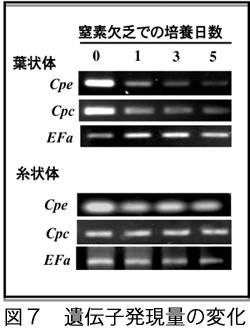
フィコエリスリンやフィコシアニンの遺伝子の発現量も葉状体では窒素欠乏により素早く減少するのに対し、糸状体では窒素欠乏5日間では変化が見られませんでした(図7)。
葉状体の培養では、通気により培養液が撹拌されていますが、糸状体は静置培養されています。糸状体でみられたストレス応答の鈍さは生理活性が葉状体よりも低いことに起因するのではないかとも考えられます。しかし、過剰の重金属(銅)添加による色落ちでは糸状体も葉状体もほぼ同じスピードで応答しました。このことから、糸状体には窒素欠乏による色落ちを防ぐ何らかの仕組みがあるのかもしれません。
イ)有機ハロゲン耐性能
 スサビノリの葉状体は人工気象器内で培養されています。以前は人工気象器を廊下において使用していましたが、一昨年の大学の改修工事終了後は、それらは新築の実験室に移されました。しかし、移設当初から葉状体の成長が悪く研究を進めることができなくなりました。
スサビノリの葉状体は人工気象器内で培養されています。以前は人工気象器を廊下において使用していましたが、一昨年の大学の改修工事終了後は、それらは新築の実験室に移されました。しかし、移設当初から葉状体の成長が悪く研究を進めることができなくなりました。
不思議なことに、同じ実験室内にあるノリ以外の植物は正常に生育していました。その後一年間、ノリの生長阻害の原因を検索してきましたが、最近になり実験室内の空気が悪いことがわかりました。そのきっかけは単純なことで、ノリを培養していた人工気象器を別の部屋に移すと症状は見られなくなることでした(図8)。
ノリの成長を阻害するガス成分については今のところ詳細は不明ですが、植物培養室内の換気扇に有機ハロゲンを吸着するフィルターを設置すると症状が緩和したことから、微量の有機ハロゲンがノリ葉状体の成長を阻害しているのではないかと推定しています。今後、室内ガスの成分分析を行い、ノリの生長阻物質を同定したいと考えています。なお、このようなトラブルはノリの糸状体ではまったく見られないことも興味深い現象です。
ウ)ブロモペルオキシダーゼ遺伝子
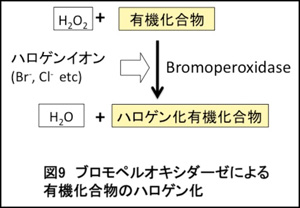 海水に多量に存在するハロゲン(Cl、Br、Iなど)は海藻体内に取り込まれて、ハロゲン化有機化合物が合成されます。この反応を触媒するのがハロペルオキシダーゼ(ブロモペルオキシダーゼ)であると考えられています(図9)。
海水に多量に存在するハロゲン(Cl、Br、Iなど)は海藻体内に取り込まれて、ハロゲン化有機化合物が合成されます。この反応を触媒するのがハロペルオキシダーゼ(ブロモペルオキシダーゼ)であると考えられています(図9)。
現在までに多くの海藻類で有機ハロゲン合成能が報告されています。紅藻類でもサンゴモではブロムペルオキシダーゼの働きにより有機ハロゲンが合成され、抗菌作用として利用されていることが示唆されています(図10)。
しかし、スサビノリを含むアマノリ属では有機ハロゲン生成の報告はありませんでした。私たちは、かずさDNA研究所から公開されている葉状体と糸状体のESTデータベースから、糸状体に特異的に発現する遺伝子としてブロムペルオキシダーゼがあることにきづきました。そこで、葉状体と糸状体からRNAを抽出してPCRにより遺伝子の発現量を調べたところ、通常の培養条件では葉状体のプロムペルオキシダーゼ遺伝子の発現レベルが非常に低いのに対し、糸状体では高発現していました。細胞抽出液を用いた酵素活性でも同様の傾向がみられました。ブロモペルオキシダーゼの発現が高いことから、糸状体は各種生理活性物質の合成能が高い可能性が考えられます。
偶然始めた糸状体の研究ですが、葉状体とは著しく異なる生理特性がみいだされました。特に、有機ハロゲンについは興味がもたれます。海藻の作る有機ハロゲンは海藻自身の生活にも活用されているだけでなく、地球環境にも影響を与えているのではないかと注目されています(図11)。この特性の分子機構を明らかにすることは養殖ノリの分子育種や新たな利用法の開発にもつながる可能性があるのではないかと期待しています。また、ノリも特殊な環境では有機ハロゲンを生成することから、ノリ養殖の盛んな地域の大気環境についても新たな問題を提起するかもしれません。
